
表1. 前列腺及精囊腺肿瘤常用免疫组化指标

前列腺肿瘤免疫组化多用于腺癌(腺泡、导管)和基底细胞癌的诊断;具体指标的选择,也应根据形态学考虑而定。具体来说,前列腺上皮常用免疫组化标记有:前列腺特异性抗原(prostate specific antigen,PSA),前列腺酸性磷酸酶(prostatic acid pho-sphatase,PAP),NKX3.1,prostein,AR,ERG,人腺激肽释放酶-2(human glandular kallikrein-2,hK2),AMACR/p504S;而基底细胞常用免疫组化标记有高分子量CK(CK5,CK6,CK14,34βE12),p40,p63。
阳性表达模式:细胞质
推荐阳性质控组织:前列腺组织
PSA是一种由前列腺上皮合成并分泌入前列腺导管的单链糖蛋白,因此PSA是前列腺实质和前列腺癌最特异性标记之一。如果有转移癌的免疫组化结果为广谱CK阳性但CK5、CK7、CK14、CK20均为阴性,则提示前列腺原发癌可能,加做PSA和/或NKX3.1可证实肿瘤为前列腺来源。需要注意的是,约10%的高级别前列腺癌为PSA阴性。这样的病例中,其他前列腺特异性标记如NKX3.1、前列腺特异性膜抗原、PAP、AR等可用于证实诊断。前列腺癌之外的其他肿瘤,也曾有过低水平表达PSA的报道:PSA弱阳性表达可见于部分涎腺导管癌、小细胞癌、乳腺癌、子宫内膜样癌。阳性表达模式:细胞质,高尔基体区
推荐阳性质控组织:前列腺组织
Prostein是一种见于前列腺分泌上皮中高尔基体的跨膜转运蛋白。在确定肿瘤为前列腺来源方面,该指标要比PSA更为特异、且稍敏感。Prostein表达缺失与前列腺癌临床预后不良有关,正因为如此,prostein阴性不能排除前列腺来源。实际工作中,prostein可以和NKX3.1、PSA组合,用于原发灶未明肿瘤的确诊,或区分前列腺、尿路上皮、结直肠癌。
阳性表达模式:细胞质
推荐阳性质控组织:前列腺组织
PAP是一种由前列腺上皮分泌的酶,是前列腺液的主要成分。用于前列腺及前列腺癌标记时,PAP比PSA更为敏感,但特异性稍弱。不过,PAP也可表达于不同来源的神经内分泌肿瘤,这一特点在低分化前列腺癌、前列腺癌伴神经内分泌分化、神经内分泌肿瘤的鉴别中非常重要。PAP也可与PSA组合用于原发灶未明转移性肿瘤的诊断。阳性表达模式:细胞核
推荐阳性质控组织:前列腺组织
多种不同组织均可有AR表达,具体如前列腺、皮肤附属器。肿瘤性前列腺腺体一般为AR阳性,但有研究表明,AR表达强度与内分泌治疗效果之间并无直接联系。此外,AR阳性不仅局限于前列腺癌,其他形态学类似的癌也可出现AR阳性表达,如涎腺导管癌、乳腺癌、大汗腺癌。AR免疫组化阳性着色为细胞核,因此可以考虑与其他胞质着色、胞膜着色的抗体联合用于双染。阳性表达模式:细胞质
推荐阳性质控组织:前列腺癌
AMACR也称p504S,其功能与支链脂肪酸代谢、胆酸合成有关,表达于多种正常及肿瘤性细胞的线粒体及过氧化物酶体。相比良性前列腺腺体来说,前列腺癌的时候AMACR过表达。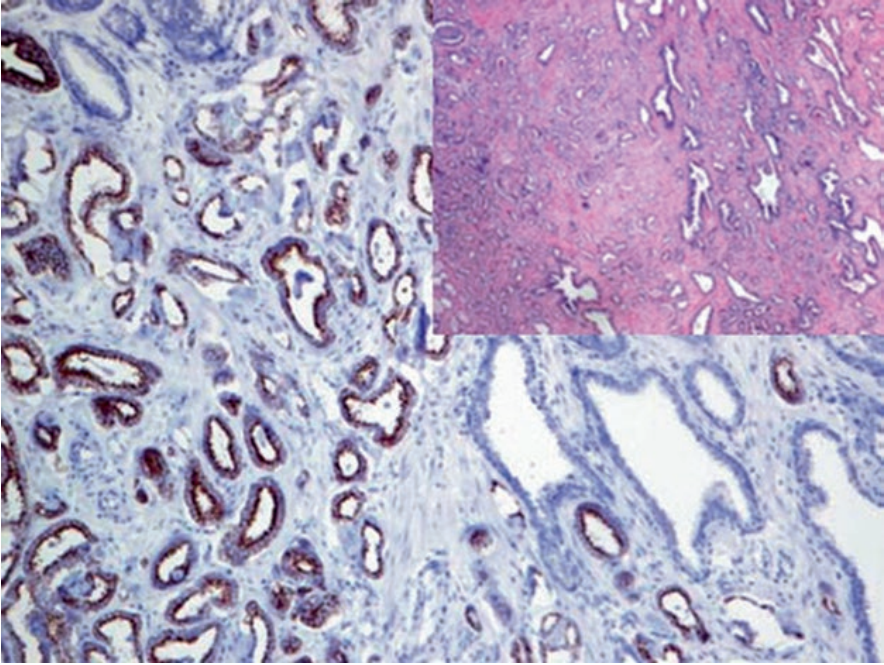
图1. 前列腺腺癌,腔面细胞表达AMACR。
目前,该指标与p63联合,广泛用于前列腺癌的诊断;其中p63用于肌上皮标记,且为细胞核着色。具体来说,这一双染做法的结果可具体归为下述三种情况之一:AMACR阳性前列腺腺体,缺失p63阳性的肌上皮,这是肿瘤性腺体的特征;AMACR阳性前列腺腺体,周围有p63阳性的肌上皮,这是前列腺高级别PIN的特征;AMACR阴性前列腺腺体,周围有p63阳性的肌上皮,这是正常前列腺的特征。AMACR的表达,还可见于多种其他肿瘤,因此实际工作中应注意,该指标并非前列腺肿瘤所特有。P63免疫组化检测中,可用低分子量CK(如CK5&6、CK14)来代替。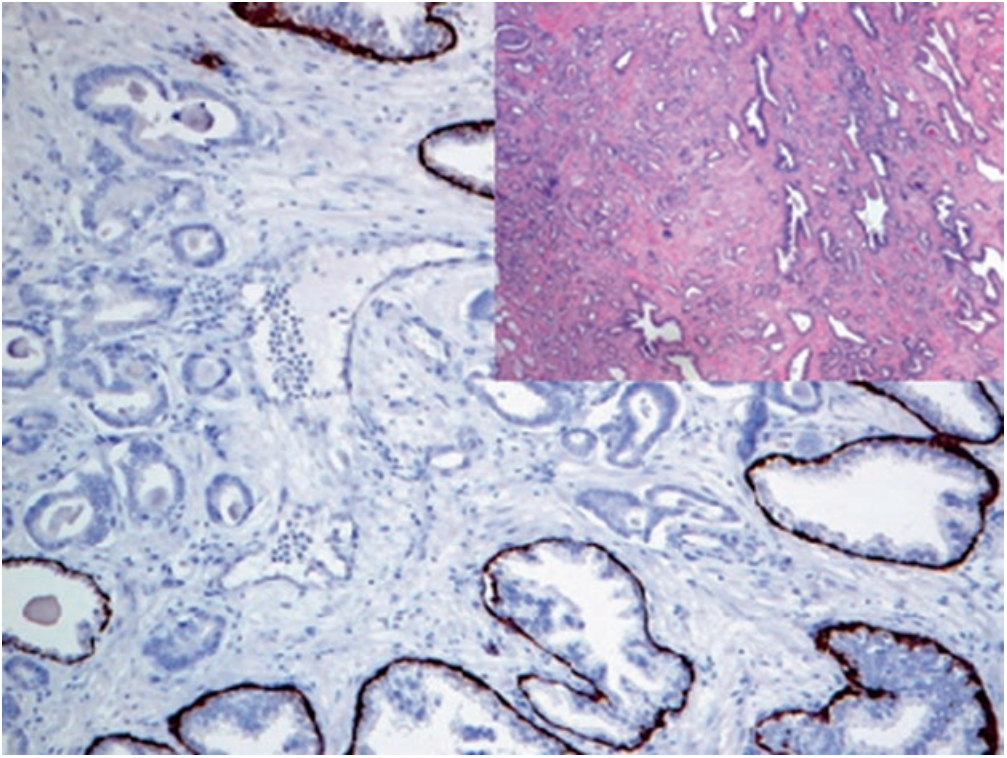
图2. 前列腺腺癌,高分子量CK(CK5/14)免疫组化,肿瘤性腺体并无基底层细胞。
阳性表达模式:细胞核
推荐阳性质控组织:前列腺组织
NKX3.1在正常前列腺上皮及前列腺腺泡癌的细胞核中为强阳性表达。该指标对于原发前列腺癌相对特异,且细胞核着色的强度与肿瘤分化级别有关,低分化癌中表达极弱。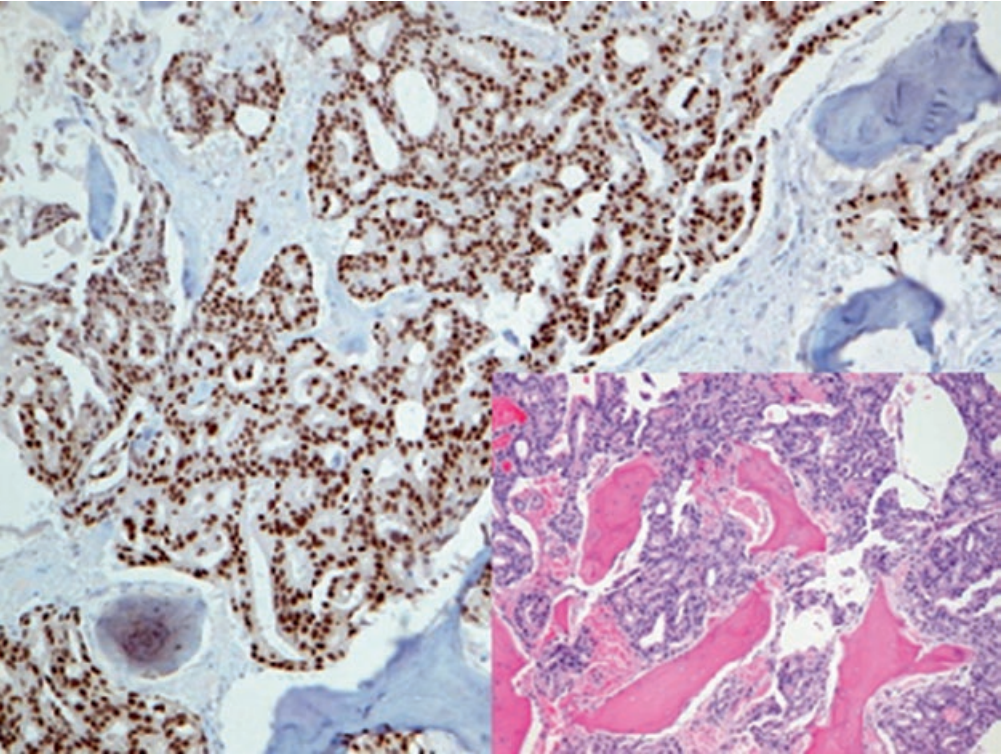
图3. 转移性前列腺癌,免疫组化NKX3.1在细胞核呈强阳性表达。
需要注意的是,NKX3.1也表达于睾丸原位生殖细胞肿瘤及原位精原细胞瘤,而浸润性精原细胞瘤和胚胎性癌中表达缺失。ER及AR阳性乳腺癌(如浸润性小叶癌)中,也有NKX3.1的不同程度阳性。涎腺的黏液单位及支气管腺体也可有NKX3.1的细胞核着色,在小活检标本中有利于结果判定。此外,肿瘤性淋巴细胞中可因为TAL-1基因异常而激活NKX3.1的表达。阳性表达模式:细胞核
推荐阳性质控组织:血管
ERG是ETS家族转录因子成员之一,具体包括Fli-1和ETS-1。正常情况下,ERG表达于血管内皮细胞及这类细胞来源的肿瘤。ERG基因是TMPRSS2基因的融合配体,与雄激素效果的调节有关。该基因的突变前列腺癌中最常见的遗传学异常,可见于40-80%的病例。ERG基因突变,导致TMPRSS2-ERG基因融合,免疫组化检测中ERG过表达。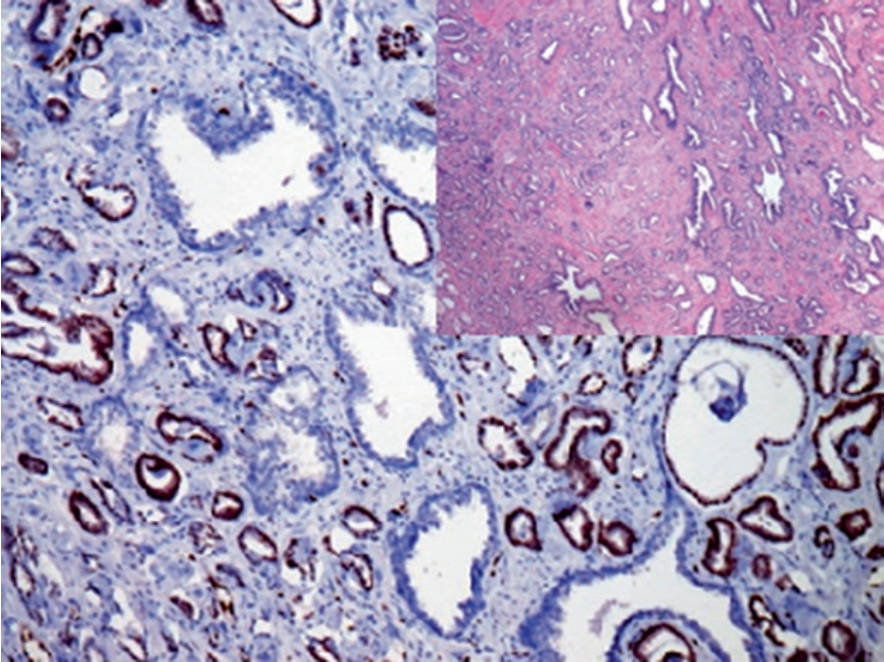
图4. 前列腺腺癌,免疫组化ERG在肿瘤性细胞的细胞核呈阳性表达。
ERG的异常表达还可见于孤立性纤维性肿瘤,因为该肿瘤也有这一遗传学异常。少数其他间质性肿瘤也有ERG的过表达,如上皮样肉瘤、纤维性脑膜瘤。尽管缺乏敏感性,但原发灶未明的上皮性转移性肿瘤中出现ERG阳性,可以考虑为前列腺来源的癌。前列腺标本ERG免疫组化结果的解读必须慎重,因为约29%的前列腺高级别PIN、个别良性腺体中也会出现ERG阳性;因此,前列腺癌的诊断金标准仍是肌上皮细胞的标记。ERG和p63可组成双染试剂用于前列腺癌的诊断,不过较前AMACR、p63的组合来说敏感性要弱一些。
如前所述,PTEN是一种肿瘤抑制因子,Gleason评分较高的前列腺癌中有部分会发现PTEN的表达缺失,这种病例一般会抗雄激素治疗耐药。此外,PETN表达缺失也可以用于鉴别导管内癌和PIN,后者一般PTEN阳性。
迈迈划重点:“AMACR/p504s常与p63、CK5/6(或34βE12)联合用于前列腺肿瘤的诊断。AR阳性表达与前列腺癌的组织分化程度有关,阳性者对抗激素治疗效果显著。ERG除了用于前列腺癌的诊断之外,几乎所有内皮肿瘤中也有表达,因此还可作为内皮标记物。PSA与NKX3.1联合检测用于前列腺癌和转移性前列腺癌的诊断,但同时应注意在一些高级别的前列腺癌中可能出现阴性。与此有相似之处的是,Gleason评分较高的前列腺癌中有部分会发现PTEN的表达缺失。”
抗体名称 | 克隆号 | 阳性对照 | 细胞定位 |
AMACR/p504s | 13H4 | 前列腺癌、肾脏
| 胞质 |
AR | EP120 | 前列腺、睾丸 | 胞核 |
ERG* | MXR004
| 血管肉瘤、前列腺癌
| 胞核
|
NKX3.1
| EP356 | 前列腺癌 | 胞核 |
PSA* | MX030
| 前列腺 | 胞质
|
PTEN
| 6H2.1 | 前列腺增生 | 胞核 |
更多信息,请详询:800-8581156或400-889-9853





